‘WB Institute’ এর পক্ষ থেকে সকলকে জানাই সাদর আমন্ত্রন। আমরা এই পর্বে মডেল অ্যাক্টিভিটি টাস্ক ক্লাস ১০ পার্ট ২ ( Model Activity Task Class 10 Part 2) – এর ভৌতবিজ্ঞান (Physical Science) এই বিষয়ের প্রশ্ন-উত্তর নিয়ে আলোচনা করা হয়েছে।
প্রিয় দ্বিতীয় শ্রেণীর ছাত্র-ছাত্রীরা,
প্রথম পর্যায়ক্রমিক মূল্যায়নের জন্য নির্ধারিত পাঠ্যসূচিকে ভিত্তি করে মডেল অ্যাক্টিভিটি টাস্কগুলি তৈরি করা হয়েছে। বর্তমান পরিস্থিতিতে সমস্ত বিদ্যালয় আপাতত বন্ধ রয়েছে। ছাত্রছাত্রীরা বাড়িতে নিজের বিষয়ভিত্তিক খাতায় এগুলো করে বিদ্যালয় খুললে শিক্ষকের কাছে এই মডেল অ্যাক্টিভিটি টাস্ক (Mode Activity Task) জমা দেবে। কোন অবস্থাতেই তারা যেন বাড়ির বাইরে না বের হয় । প্রয়োজনে তোমরা বিদ্যালয়ের শিক্ষিকা-শিক্ষকদের সহায়তা নিতে পারো।
Table of Contents
ফেব্রুয়ারি মডেল অ্যাক্টিভিটি টাস্ক পার্ট ২ ( দশম শ্রেণী )
বিষয় – ভৌতবিজ্ঞান
পূর্ণমান – ২০
February Model Activity Task Class 10 Part 2 Answer
( গণিত )
১. ঠিক উত্তর নির্বাচন করাে : (১x৩ = ৩)
১.১ SATP বলতে যে উষ্ণতা বােঝায় তার মান নিকটতম পূর্ণসংখ্যায় –
(ক) 263 K
(খ) 273 K
(গ) 298 K
(ঘ) 373 K
১.২ PV = \frac{W}{M} RT সমীকরণে (চিহ্নগুলি প্রচলিত অর্থ বহন করে) ‘M’ রাশির একক হল –
(ক) g
(খ) g mol
(গ) g/mol
(ঘ) mol-1
১.৩ কোনাে আদর্শ গ্যাসের ক্ষেত্রে স্থির উম্নতা ও স্থির ভর হলে বয়েলের সূত্রানুসারে চাপ ও আয়তনের লেখচিত্রটি হবে –
(ক) মূলবিন্দুগামী সরলরেখা
(খ) উপবৃত্তের অংশ
(গ) পরাবৃত্তের অংশ
(ঘ) আয়তনের অক্ষের সমান্তরাল সরলরেখা
২. নীচের বাক্যগুলি সত্য অথবা মিথ্যা তা নিরূপণ করাে : (১x৩ = ৩)
২.১ একটি গ্যাস অণুর আয়তন = (গ্যাস দ্বারা অধিকৃত আয়তন ÷ গ্যাস অণুর সংখ্যা)
২.২ 12C = 12.0000 u-এর পরিবর্তে অন্য কোনাে সাংখ্যমান ধরা হলেও STP-তে কোনাে গ্যাসের মােলার আয়তন একই থাকবে।
২.৩ নির্দিষ্ট উষ্ণতা ও চাপে দুটি আদর্শ গ্যাসের আয়তন অনুপাত গ্যাসদুটির মােল সংখ্যার অনুপাতের সমান।
৩. সংক্ষিপ্ত উত্তর দাও : (২x৪ = ৮)
৩.১ মাত্ৰীয় বিশ্লেষণ থেকে গ্যাস ধুবক ‘R’-এর একক কী হওয়া উচিত তা দেখাও।
উত্তর:– আদর্শ গ্যাস সমীকরণের মাত্রিক বিশ্লেষণ থেকে R-এর একক. নির্ণয়> n mol গ্যাসের জন্য আদর্শ গ্যাস
সমীকরণ, pV = nRT থেকে পাই, R = \frac{pV}{nT}
সুতরাং , SI পদ্ধতিতে R –এর একক হল – J. mol-1 .K-1 এবং CGS পদ্ধতিতে R –এর একক হল – erg.mol-1.K-1
[এখানে উষ্ণতা হল পরম উষ্ণতা । তাই এর একককে কেল্ভিন(K) এককেই প্রকাশ করা হয় ]৩.২ প্রধানত কোন কোন কারণে বাস্তব গ্যাসগুলি আদর্শ আচরণ থেকে বিচ্যুত হয়?
উত্তর:– শুধুমাত্র নিম্নচাপ ও উচ্চ উষ্ণতায় বাস্তব গ্যাসগুলি আদর্শ গ্যাসের মতাে আচরণ করে। অন্যান্য ক্ষেত্রে বাস্তব গ্যাসগুলি আদর্শ গ্যাসের সমীকরণ মেনে চলে না। এই বিচ্যুতির কারণগুলি নিম্নে আলোচনা করা হল –
(i) আয়তন সংক্রান্ত ত্রুটি:- গ্যাসের গতীয় তত্ত্বে গ্যাস অণুগুলিকে বিন্দু রূপে কল্পনা করা হয়েছিল এবং গ্যাস অণুগুলির মোট আয়তন গ্যাস আধারের আয়তনের তুলনায় নগণ্য ধরা হয়েছিল । কিন্তু বাস্তবে গ্যাসের অণুগুলি অত্যন্ত ক্ষুদ্র হলেও এদের নির্দিষ্ট আয়তন আছে । ফলে উপরিউক্ত কল্পনা খুব উচ্চ উষ্ণতা বা খুব নিম্ন চাপে (যখন গ্যাসের আয়তন খুব বেশি ) সত্য হলেও অন্য সময়ে নির্ভুল নয় । অর্থাৎ সাধারন চাপ ও উষ্ণতায় বাস্তব গ্যাসের অণুগুলির অবাধ বিচরণের জন্য কার্যকরী আয়তন পাত্রের আয়তনের তুলনায় কিছুটা কম হয় ।
(ii) চাপ সংক্রান্ত ত্রুটি:- গ্যাসের গতীয় তত্ব অনুসার গ্যসের অণুগুলির মধ্যে কোনো আকর্ষন বল ক্রিয়া করেনা । কিন্তু অধিক চাপে গ্যাসের আয়তন কম হওয়ায় অণুগুলি যথেষ্ট কাছাকাছি চলে আসে , ফলে অণুগুলির মধ্যে আকর্ষণ বল ক্রিয়া করে । এর ফলে আদর্শ অবস্থায় আকর্ষণ মুক্ত অণুগুলি দেওয়ালে যে পরিমাণ ধাক্কা দিত, তা বাস্তব গ্যাসের অণু দিতে পারে না ।
৩.৩ স্থির চাপে স্থির ভরের আদর্শ গ্যাসের ক্ষেত্রে V – t ও V – T লেখচিত্র কেমন হবে এঁকে দেখাও।
উত্তর:-
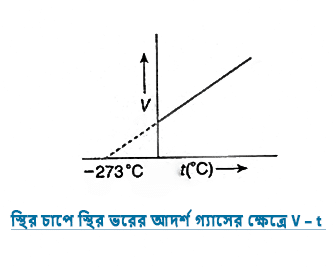
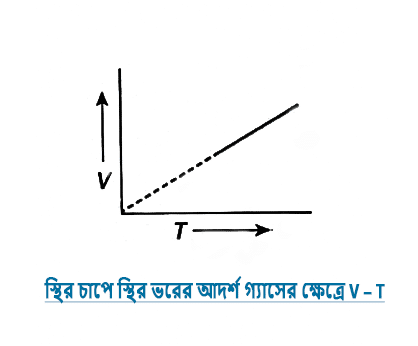
৩.৪ সম চাপে ও সম উষ্ণতায় সমআয়তনের শুস্ক বাতাস ও আদ্র বাতাসের মধ্যে কোনটি হালকা হবে যুক্তিসহ ব্যাখ্যা করো ।
উত্তর:- শুস্ক বায়ুতে অন্যান্য অনেক গ্যাস থাকলেও মূলত নাইট্রোজেন ও অক্সিজেন গ্যাস বেশি থাকে । মোটামুটি ভাবে শুস্ক বায়ুতে 4 ভাগ নাইট্রোজেন ও 1 ভাগ অক্সিজেন থাকে । নাইট্রোজেনের মোলার ভর 28g ও অক্সিজেনের মোলার ভর 28g হলে , শুস্ক বায়ুর গড় আণবিক ভর
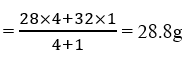
আবার , জলের (H2O) মোলার ভর = 1✕2 +16 = 18g
সুতরাং, জলীয়বাস্প , শুস্ক বায় অপেক্ষা হালকা তাই বাতাসে জলীয় বাস্প থাকলে অর্থাৎ বায়ু আদ্র হলে তার গড় আণবিক ভর , শুস্ক বায়ুর গড় আণবিক ভরের চেয়ে কম হয় । তাই শুস্ক বায়ু অপেক্ষা আদ্র বায়ু লঘু বা হাল্কা হয় ।
৪. নীচের প্রশ্ন দুটির উত্তর দাও : (৩x২ = ৬)
৪.১ একটি আদর্শ গ্যাসের মধ্যে কিছু ধুলিকণা রয়েছে ( ধূলিকণা চাপে অনমনীয় ) । উষ্ণতা স্থির রেখে গ্যাসের চাপ দ্বিগুন করা হলে ধূলিকণাসহ গ্যাসের আয়তন 1000 mL থেকে কমে 500.25 mL হয় । ধূলিকণার সামগ্রিক আয়তন নির্ণয় করো ।
উত্তর:- ধরা যাক , গ্যাসটির প্রাথমিক চাপ (P1) = P
∴ অন্তিম চাপ(P2) = 2P
ধূলিকণা সহ গ্যাসটির প্রাথমিক আয়তন = 1000mL এবং অন্তিম আয়তন = 500.25 mL
ধরি , ধূলিকণার আয়তন v mL
∴ ধূলিকণা ছাড়া গ্যাসটির প্রাথমিক আয়তন (V1) = (1000-v)mL এবং অন্তিম আয়তন (V2) = (500.25-v) mL
যেহেতু , গ্যাসটির উষ্ণতা স্থির , সেহেতু বয়েলের সূত্রানুযায়ী ,
P1V1 = P2V2
বা, P (1000-v) = 2P (500.25-v)
বা, 1000 –v = 2 (500.25-v)
বা, 1000 –v = 1000.50-2v
বা, 2v –v = 1000.50- 1000
বা, v = 0.50
∴ ধূলিকণার সামগ্রিক আয়তন = 0.50 mL
৪.২ 760 mm Hg চাপে 0°C উয়তায় 3.2 g যে গ্যাসের আয়তন 2.24 L তার গ্রাম আণবিক ওজন নির্ণয় করাে। সাধারণ হাইড্রোজেনের অণু অপেক্ষা গ্যাসের একটি অণু কতগুণ ভারী?
উত্তর:-
প্রদত্ত চাপ, P = 760 mm Hg = 1atm
উষ্ণতা (T)= 0° C = 273K
গ্যাসের ভর (W) = 3.2g
আয়তন (V) = 2.24L
আণবিক ওজন (M) = ?
সার্বজনীন গ্যাস ধ্রুবক (R ) = 0.082L .atm.mol-1.K-1
ধরি, গ্যাসটির আণবিক ওজন ‘M’


∴ গ্যাসটির আণবিক ওজন = 32g /mol

∴ গ্যাসের একটি অণুর ভর = D ✕ একটি হাইড্রোজেন অণুর ভর
∴ সাধারণ হাইড্রোজেন অণু অপেক্ষা গ্যাসের একটি অণু D গুণ ভারী (যেখানে , D = গ্যাসের বাস্পঘনত্ব ) ।
অনলাইন প্লাটফর্ম ব্যাবহার করা একজন নবীন ছাত্র-ছাত্রি বা তাদের পিতা-মাতার কাছে কিছুটা কঠিন মনে হতে পারে। যাইহোক, এটি মোটেই নয় কারণ আপনি উপরে উল্লিখিত ধাপে ধাপে লেখা উত্তরগুলি অনুসরণ করে এটি সমাধান করতে পারেন। যদি আপনি আপনার সমস্যা থেকে সমাধান না পেয়ে থাকেন তাহলে আমাদের অবশ্যই জানাবেন।